Диабет у детей и подростков
 221
221

Типы сахарного диабета (СД) у детей сходны с таковыми у взрослых, но психологические проблемы отличаются и могут усложнить лечение.
Āsbe Teferī СД 1 типа является наиболее распространенным типом у детей, и составляет две трети новых случаев у детей всех этнических групп.
Это одно из самых распространенных хронических заболеваний детского возраста, с частотой случаев 1 на 350 детей до 18 лет; в последнее время заболеваемость увеличивается, особенно среди детей < 5 лет.
Хотя диабет 1 типа может возникнуть в любом возрасте, как правило, проявляется это заболевание между 4 и 6 годами, а также между 10 и 14 годами.
can you buy prednisone over the counter СД 2 типа, когда-то редкое заболевание у детей, которое встречается все чаще параллельно с увеличением детского ожирения.
Он, как правило, проявляется после полового созревания, с высокой частотой между 15 и 19 годами.
Моногенные формы диабета, ранее называемые юношеским инсулинонезависимым сахарным диабетом(MODY), не относят к 1 или 2 типу (хотя иногда ошибочно принимают за них). Они встречаются редко (от 1 до 4% случаев).
Предиабет является нарушением регуляции уровней глюкозы, приводящим к возникновению промежуточных уровней, которые выше нормы, но не отвечают критериям постановки диагноза диабета. У тучных подростков, предиабет может разрешаться (возвращение к норме через 2 года у 60% подростков) или переходить в диабет, особенно у подростков, которые упорно набирают вес.
Предиабет связан с метаболическим синдромом (нарушение регуляции гликемии, дислипидемия, гипертензия, ожирение).
Причины
Предполагают, что семейная составляющая характерна для всех типов СД у детей, хотя заболеваемость и механизмы развития различны.
При СД 1 типа поджелудочная железа не вырабатывает инсулин из-за аутоиммунной деструкции β-клеток поджелудочной железы (индуцируемой, вероятно, факторами внешней среды у генетически предрасположенных лиц). Близкие родственники подвержены повышенному риску СД, с общей частотой 10 — 13% (30 — 50% у монозиготных близнецов).
Дети с СД 1 типа более подвержены риску других аутоиммунных заболеваний, в частности, заболеваниям щитовидной железы и целиакии. Наследственная предрасположенность к СД 1 типа определяется несколькими генами (были определены > 60 локусов риска).
Гены предрасположенности в некоторых популяциях встречаются чаще, что объясняет высокую частоту СД 1 типа среди представителей определенных этнических групп (например, скандинавы, сардинцы).
При СД 2 типа, поджелудочная железа производит инсулин, но возникает резистентность к инсулину, выраженная в различной степени, и секреция инсулина не соответствует растущей потребности, вызванной резистентностью к инсулину (то есть, существует относительный дефицит инсулина.
Начало часто совпадает с пиком физиологической пубертатной резистентности к инсулину, которая может привести к появлению симптомов гипергликемии у ранее компенсированных подростков.
Причиной является не аутоиммунное разрушение бета-клеток, а сложное взаимодействие множества генов и факторов окружающей среды, которые отличаются в разных популяциях и у разных пациентов.
К факторам риска относятся:
-
Ожирение
-
Наследственность по СД (положительный семейный анамнез (от 60 до 90% имеют 1-ю или 2-ю степень родства с больными СД 2 типа)
Моногенные формы диабета вызваны генетическими дефектами, которые наследуются по аутосомно-доминантному типу, поэтому в семьях пациентов, как правило, встречается более одного случая этой патологии. В данном случае, нет резистентности к инсулину или аутоиммунного разрушения бета-клеток. Начало обычно в возрасте до 25 лет.
Патофизиология
При СД 1 типа, недостаток инсулина вызывает гипергликемию и нарушение утилизации глюкозы в скелетных мышцах. Тогда мышцы и жир расщепляются, чтобы обеспечить энергетические потребности. Распад жиров приводит к образованию кетонов, которые вызывают ацидемию, а иногда и значительный, опасный для жизни ацидоз (Диабетический кетоацидоз (ДКА) ).
При СД 2 типа, как правило, инсулина достаточно для предотвращения ДКА на момент постановки диагноза, но у детей, иногда, заболевание может начинаться с ДКА (до 25%) или, еще реже, с гипергликемического гиперосмолярного состояния (HHS—Некетозный гиперосмолярный синдром (НКГС) ), при котором возникает тяжелая гиперосмолярная дегидратация.
Гиперосмолярное гипергликемическое состояние (HHS) чаще всего возникает во время стресса или инфекции, при несоблюдении режима лечения, или когда метаболизм глюкозы еще более снижается из-за лекарственных препаратов (например, кортикостероидов).
Другие метаболические нарушения, связанные с резистентностью к инсулину включают:
-
Дислипидемию (что приводит к атеросклерозу)
-
Артериальную гипертензию
-
Синдром поликистозных яичников
-
Синдром обструктивного апноэ сна (СОАС)
-
Неалкогольный стеатогепатит (Жировая печень)
Атеросклероз начинается в детстве и юности, и заметно увеличивает риск сердечно-сосудистых заболеваний.
При моногенных формах СД, основной дефект зависит от типа. Наиболее распространенные типы обусловлены дефектами транскрипционных факторов, которые регулируют функцию β-клеток поджелудочной железы (например ядерный фактор гепатоцитов 4-альфа [HNF-4-α] и ядерный фактор гепатоцитов 1-альфа [HNF-1-α]). При этих типах, секреция инсулина нарушена, но не отсутствует, нет резистентности к инсулину, и гипергликемия ухудшается с возрастом.
Другой тип моногенного СД вызван дефектом сенсора глюкозы, глюкокиназы. При дефекте глюкокиназы, инсулин вырабатывается нормально, но регуляция уровней глюкозы ориентирована на более высокие значения, что приводит к гипергликемии натощак, и минимально ухудшается с возрастом. Возможные сложности Несмотря на распространенное заблуждение, ДКА может возникать у детей с СД 2 типа.
Признаки
При СД 1 типа, начальные проявления бывают различными — от бессимптомной гипергликемии до угрожающего жизни кетоацидоза.
Тем не менее, чаще всего, у детей появляются симптомы гипергликемии без ацидоза, в виде
-
частого мочеиспускания (полиурия)
-
повышенного аппетита
-
жажды, длительностью от нескольких дней до нескольких недель.
-
Полиурия может проявляться как никтурия (преобладание ночного диереза над вечерним)
-
ночное или дневное недержание мочи
-
у детей, которые сами не ходят в туалет, родители могут отметить, что подгузники чаще становятся влажными или тяжелыми.
-
Около половины детей теряют вес в результате повышенного катаболизма, также нарушается процесс роста.
-
Вначале также могут появлятся утомляемость, слабость, кандидозная сыпь, нечеткое зрение (из-за гиперосмолярного состояния хрусталика и стекловидного тела), и/или тошнота и рвота (вследствие кетонэмии).
СД 2 типа у детей часто протекает бессимптомно, и их состояние может быть обнаружено только при плановом обследовании.
Тем не менее, у некоторых детей появляются симптомы гипергликемии, гипергликемического гиперосмолярного состояния, или, несмотря на распространенное заблуждение, ДКА.
Осложнения
ДКА (Диабетический кетоацидоз) распространен среди пациентов с установленным СД 1 типа.
Ежегодно он возникает примерно у 1 — 10% пациентов, как правило, из-за того что они не приняли инсулин.
Другие факторы риска ДКА включают предыдущие эпизоды кетоацидоза, сложные социальные условия, депрессию или другие психические расстройства, сопутствующие заболеваний и использование инсулиновой помпы (из-за перекручивания или выхода катетера, плохой абсорбции инсулина из-за воспаления в месте инфузии или неисправности помпы).
Врачи могут помочь свести к минимуму факторы риска путем образования, консультирования и поддержки пациентов.
Психосоциальные проблемы очень распространены среди детей с сахарным диабетом и их семей.
Примерно у половины детей развивается депрессия, беспокойство, или другие психологические проблемы. Расстройства пищевого поведения являются серьезной проблемой у подростков, которые также, иногда, могут пропустить введение инсулина, пытаясь, таким образом, контролировать вес. Психосоциальные проблемы могут также привести к снижению контроля гликемии, влияя на то как дети придерживаются диеты и/или режима введения лекарств. Социальные работники и специалисты по психическому здоровью (в рамках междисциплинарной команды) могут помочь выявить и облегчить психологические причины плохого контроля гликемии.
Сосудистые осложнения редко проявляются в детском возрасте. Тем не менее, ранние патологические изменения и функциональные нарушения могут появляться через несколько лет после начала болезни. Микрососудистые осложнения включают диабетическую нефропатию, ретинопатию и нейропатию.
Макрососудистые осложнения включают поражение коронарных артерий и периферических сосудов, а также инсульт.
Несмотря на то, что нейропатия является более распространенной среди детей, у которых диабет возник давно (≥ 5 лет) и плохо контролируетсяу (гликозилированный гемоглобин [HbA1c] > 10%), она может появится и у маленьких детей, у которых диабет возник недавно и хорошо контролируется.
Диагностика
-
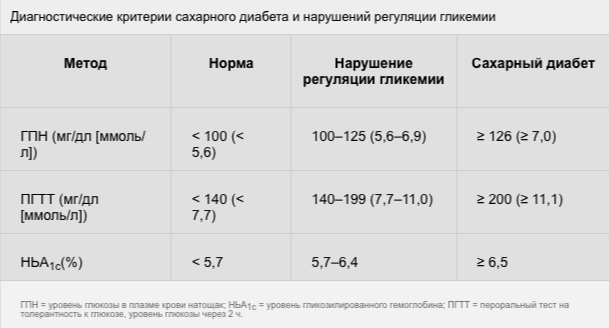
Уровень глюкозы в плазме натощак ≥ 126 мг/дл (≥ 7,0 ммоль/л)
-
Случайный уровень глюкозы ≥ 200 мг/дл (≥11,1 ммоль/л)
-
Гликозилированный гемоглобин (HbA1c) ≥ 6,5%
-
Иногда – пероральный глюкозо-толерантный тест
Диагностика сахарного диабета
Диагностика СД и предиабета проводится так же как у взрослых, и, как правило, включает определение глюкозы в плазме натощак или случайного уровня глюкозы и/или уровня HbA1c, и зависит от наличия или отсутствия симптомов.
Диагноз диабета можно поставить при наличии классических симптомов диабета и повышении уровня глюкозы крови (глюкоза плазмы ≥ 200 мг/дл (≥ 11,1 ммоль/л) или глюкоза натощак ≥ 126 мг / дл (≥ 7,0 ммоль/л); натощак значит воздерживаясь от приема пищи в течении 8 ч).
Пероральный тест толерантности к глюкозе не является необходимым, и не должен проводится, если диабет можно диагностировать по другим критериям. При необходимости, тест проводится с использованием 1,75 г/кг (максимально 75 г) глюкозы, растворенной в воде.
Этот тест может быть полезен у детей без симптомов диабета или с мягкой или атипичной симптоматикой, а также в случаях подозрения на СД 2 типа или моногенные формы СД.
НВA1c критерий, как правило, применяют для диагностики СД 2 типа и гипергликемии, которую нужно подтвердить.
Первичное обследование и лабораторные методы диагностики
У пациентов с подозрением на сахарный диабет, которые не выглядят больными, первоначальное тестирование должно включать основную метаболическую панель, в том числе определение электролитов и глюкозы, а также анализ мочи. У больных, тестирование также включает исследование газового состава артериальной и венозной крови, функциональные пробы печени, и определение уровней Ca, Mg, P, и гематокрит.
Диагностика типов сахарного диабета
Дополнительные тесты должны быть проведены, чтобы подтвердить тип диабета, включая:
- Уровни С-пептида и инсулина (если еще не проводилось лечение инсулином)
- Уровни НЬA1c (если еще не определяли)
- Тесты на аутоантитела против белков островковых клеток поджелудочной железы
Аутоантитела включают декарбоксилазу глутаминовой кислоты, инсулин, протеин, ассоциированный с инсулиномой, и переносчик цинка ZnT8.
Более 90% пациентов с впервые выявленным СД 1 типа имеют ≥ 1 из этих аутоантител, в то время как отсутствие антител является признаком СД 2 типа. Тем не менее, около 10 — 20% детей с фенотипом СД 2 типа имеют аутоантитела и классифицированы как СД 1 типа, потому что такие дети с большей вероятностью будут нуждаться в терапии инсулином и подвержены большему риску развития других аутоиммунных заболеваний.
Диагностика моногенных форм диабета является важной задачей, так как его терапия отличается от лечение при СД 1 типа и СД 2 типа. Этот диагноз можно предположить у детей с семейным анамнезом диабета, которые не имеют характерных особенностей СД 2 типа; то есть, у них есть только незначительное повышения уровня глюкозы натощак (100 — 150 мг/дл) или постпрандиальная гипергликемия, они молоды и не страдают ожирением, не имеют аутоантител или признаков резистентности к инсулину (например, чернеющий акантоз). Для подтверждения моногенных форм диабета доступно генетическое тестирование. Это тестирование играет важную роль, поскольку некоторые моногенные формы СД могут прогрессировать с возрастом.
Тестирование осложнений и других нарушений
Пациентов с СД 1 типа необходимо обследовать на другие аутоиммунные заболевания. Для этого определяют уровни антител целиакии, тиреотропного гормона, тироксина и тиреоидных антител. Пациентам с СД 2 типа проводят печеночные тесты, определение липидного профиля натощак и соотношения уровней альбумина/креатинина в моче во время постановки диагноза, поскольку такие дети (в отличие пациентов с СД 1, у которых осложнения развиваются в течение многих лет), часто уже имеют сопутствующие заболевания, такие как жировая дистрофия печени, гиперлипидемия, артериальная гипертензия.
Дети с клиническими признаками осложнений также должны быть обследованы на:
-
Ожирение
-
Тест на неалкогольный стеатогепатит
-
Дневную сонливость или храп
-
Тест на синдром обструктивного апноэ сна
-
Гирсутизм, акне или нарушения менструального цикла
-
Тест на синдром поликистозных яичников
Лечение
- Диета и физические нагрузк
- При СД 1 типа – инсулин
- При СД 2 типа – метформин и, иногда, инсулин
Интенсивное обучение и лечение детей и подростковом может помочь достичь терапевтических целей, а именно нормализации уровня глюкозы в крови, сведения к минимуму количества эпизодов гипогликемии и предотвращения или отдаления осложнений (их начала и прогрессирования).
Изменение образа жизни
К изменениям в образе жизни, которые приносят пользу всем пациентам относятся:
- Регулярное питание в количестве, соответствующем потребностям организма
- Ограничение потребления рафинированных углеводов и насыщенных жиров
- Увеличение физической активности
В целом, следует избегать термина диета, используя вместо него план приема пищи или здоровое питание.
Основной акцент делается на поощрение питания полезного для сердечно-сосудистой системы, с низким содержанием холестерина и насыщенных жиров.
При СД 1 типа, популярность базально-болюсного режима и использование подсчета углеводов (родители подсчитывают количество углеводов в приготовленной пище и используют эту цифру для расчета вводимой перед едой дозы инсулина) изменили стратегию питания.
При этом гибком подходе, потребление пищи не так строго определено. Вместо этого, меню основывается на обычных пищевых предпочтениях ребенка, а не на теоретически оптимальном рационе, которого ребенок вряд ли будет придерживаться, и доза инсулина подбирается соответственно фактическому приему углеводов.
Отношение инсулина к углеводам индивидуализированно, но изменяется с возрастом.
Хорошее практическое правило ращета инсулина для разного возраста
От рождения до 5 лет: 1 единица инсулина на 30 г углеводов
От 6 до 12 лет: 1 единица инсулина на 15 г углеводов
Подростковый возраст: 1 единица инсулина на 8 — 10 г углеводов
При СД 2 типа, пациентам рекомендуется сбросить вес и тем самым увеличить чувствительность к инсулину.
Хорошее практическое правило для определения количества калорий, необходимых ребенку в возрасте
- от 3 до 13 лет — 1000 калорий + (100 × возраст ребенка в годах).
Простые шаги для улучшения рациона и контроля потребления калорий включают:
- Устранение напитков, содержащих сахар
- Борьба с привычкой пропускать приемы пищи
- Избегание частых «перекусов» в течение дня
- Контроль размера порции
- Переход на продукты с низким содержанием жира
- Увеличение употребления пищевых волокон (больше фруктов и овощей в рационе)
Схемы инсулинотерапии при сахарном диабете 1 типа
- Инсулин является основой лечения СД 1 типа. Доступные формы препаратов инсулина аналогичны тем, которые используются у взрослых.
- Инсулин следует вводить перед едой, за исключением маленьких детей, у которых количество съеденной пищи трудно предсказать.
- Режимы дозирования зависят от возраста, уровня активности, полового созревания, и времени от постановки диагноза.
В течение нескольких недель после постановки диагноза, у многих пациентов наступает временное снижение потребности в инсулине, из-за остаточного функционирования β-клеток (фаза «медового месяца»).
Эта фаза медового месяца может длиться от нескольких месяцев до 2 лет, после чего потребность в инсулине, как правило, составляет 0,7 — 1 единицу/кг/день.
В период полового созревания, пациенты нуждаются в более высоких дозах (до 1,5 единиц/кг/день), чтобы компенсировать резистентность к инсулину, обусловленную увеличением уровня гормонов в пубертате.
Виды режимов инсулинотерапии включают:
- Базально–болюсный режим
- Режим многократных ежедневных инъекций (MDI)
- Режим с применением комбинированного инсулина
Базально-болюсный режим
Обычно предпочтителен. При этом режиме, дети ежедневно получают базовую дозу инсулина, которая затем (перед каждым приемом пищи) дополняется дозами инсулина короткого действия, рассчитанными исходя из ожидаемого потребления углеводов и измеренных уровней глюкозы.
Базальная доза может вводится 1 раз в день (иногда, у младших детей, каждые 12 ч ) в виде инъекции инсулина длительного действия (гларгин или детемир) или в виде непрерывной инфузии инсулина короткого действия (как правило, аспарт или лизпро) с использованием инсулиновой помпы, которая обеспечивает непрерывную подачу инсулина через катетер, введенный под кожу.
Болюсные дозы вводятся в виде отдельных инъекций инсулина короткого действия или с помощью инсулиновой помпы. Инъекции гларгина или детемира, как правило, вводятся за ужином или перед сном и не должны быть смешаны с инсулинами короткого действия. Базальная доза помогает поддерживать уровень глюкозы крови между приемами пищи и ночью.
Использование инсулиновой помпы для введения базальной дозы обеспечивает максимальную гибкость; помпу можно запрограммировать подавать различные дозы инсулина в разное время в течение дня и ночи. Базально-болюсный режим не подходит в том случае, когда нет надлежащего надзора за ребенком, в частности когда взрослый не может делать дневные инъекции в школе или детском саду.
Режим многократных инъекций инсулина (MDI)
может быть использован, если не подходит базально-болюсный режим (например, потому, что семье нужен более простой режим, ребенок или родители имеют иглофобии, инъекции перед обедом не могут проводится, так как ребенок находится в школе или детском саду). При этом режиме, дети, как правило, получают нейтральный протамин Хагедорна (инсулин НПХ) перед завтраком, ужином и перед сном а также получают инсулин короткого действия перед завтраком и ужином. Так как НПХ и инсулин короткого действия можно смешивать, этот режим обеспечивает меньше инъекций, чем базально-болюсный режим и может быть предпочтительным у детей младшего возраста.
Тем не менее, этот режим обеспечивает меньшую гибкость и требует установить ежедневное расписание еды и перекусов.
Режим с применением комбинированного инсулина
Включает использование препаратов 70/30 (70% инсулин аспарт протамина/30% обычного инсулина) или 75/25 (75% инсулина лиспро протамина/25% инсулина лизпро).
Режим с применением комбинированного инсулина не является лучшим выбором, но он проще и, возможно, будет более тщательно соблюдаться, так как требует меньше инъекций.
Детям вводят набор доз два раза в день, при этом две трети общей суточной дозы дают перед завтраком, а одну треть перед ужином.
Однако, этот режим обеспечивает гораздо меньшую гибкость во времени и количестве приемов пищи, а также является менее точным чем другие, из-за фиксированного соотношения.
Врачи должны подбирать наиболее подходящие схемы лечения, которых дети и их семьи смогут придерживаться для того, чтобы максимизировать контроль гликемии и, таким образом, уменьшить риск долгосрочных сосудистых осложнений.
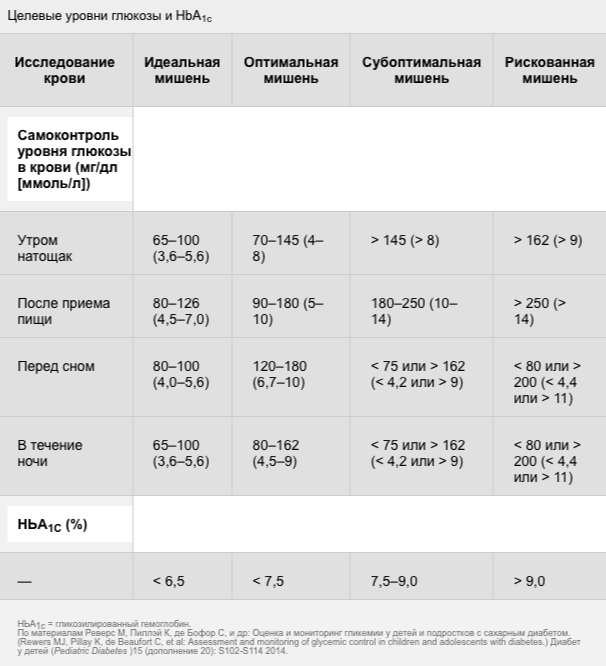
Целевые уровни глюкозы и HbA1c при сахарном диабете 1 типа
Целевые уровни глюкозы в плазме устанавливаются так, чтобы сохранять баланс межу необходимостью нормализации уровня глюкозы и риском гипогликемии.
Пациенты вне фазы медового месяца должны стараться, чтобы ≥ 50% их уровней глюкозы крови находилось в пределах нормы (от 70 до 180 мг/дл [3,9 до 10 ммоль/л]) и <10% ниже этого диапазона. Целевые уровни HbA 1c раньше были более высокими для детей младшего возраста (< 8,5%), но в последнее время, уровень < 7,5% рекомендуется всем пациентам < 18 лет, чтобы уменьшить риск негативных последствий длительной гипергликемии в детстве.
Тем не менее, многие дети и подростки не достигают этой цели. Увеличение частоты самоконтроля уровня глюкозы в крови связано с улучшением уровней HbA1c, потому что пациенты способны лучше подбирать дозы инсулина под приемы пищи, имеют лучшую способность исправлять гипергликемические значения, и потенциально могут обнаружить гипогликемию раньше, что позволяет ее корректировать (т. е., чрезмерное потребление углеводов, для лечения гипогликемии, что приводит к гипергликемии).
Лечение требует индивидуального подхода с учетом возраста пациента, продолжительности диабета, сопутствующих заболеваний и психосоциальных обстоятельств.
Риск гипогликемии у детей, с неощутимой гипогликемией или недостаточно взрослых, чтобы распознать симптомы гипогликемии может ограничивать настойчивое стремление достичь целей лечения.
Лечение осложнений сахарного диабета 1 типа
Гипогликемия
является критическим, но частым осложнением у детей, проходивших интенсивный курс лечения инсулином. У большинства детей возникает несколько мягких эпизодов гипогликемии, которые проходят после употребления 15 г быстрых углеводов (например, 4 унции сока, глюкоза в таблетках, твердые леденцы, крекеры или глюкоза в геле). Тяжелая гипогликемия, определяется как эпизод, требующий посторонней помощи, для введения углеводов или глюкагона, встречается примерно у 30% детей каждый год, а у большинства из них возникает такой эпизод до 18 лет.
Можно пробовать давать пероральные углеводы, но, если есть симптомы нейрогликопении (например, изменения поведения, спутанность сознания, затруднение мышления), которые препятствуют приему пищи или питья, обычно используется 1 мг глюкагона внутривенно.
При отсутствии лечения, тяжелая гипогликемия может привести к судорогам или, даже, коме или смерти. Устройства непрерывного мониторинга глюкозы в режиме реального времени могут помочь детям с неощутимой гипогликемией, потому что они издают звуковой сигнал, когда уровень глюкозы опускается ниже заданного диапазона или когда глюкоза снижается быстрыми темпами.
Кетонурия/кетонэмия
наиболее часто вызваны сопутствующими заболеваниями, но также могут быть результатом заниженной или пропущенной дозы инсулина и могут быть предвестниками наступления ДКА.
Поскольку раннее выявление кетонов критично для предотвращения перехода в ДКА и минимизации необходимости неотложной помощи или госпитализации, необходимо обучать детей и членов их семьи тому как определять кетоны в моче или капиллярной крови, с использованием тест-полосок.
Тестирование крови на наличие кетонов может быть предпочтительным у младших детей, детей, с рецидивирующим ДКА, и детей, пользующихся инсулиновой помпой, а также когда трудно получить образец мочи.
Определение кетонов должно проводится, всякий раз когда ребенок заболевает (независимо от уровня сахара в крови), или когда повышен уровень сахара крови (обычно > 240 мг/дл [13,3 ммоль/л]).
Умеренный или высокий уровень кетонов мочи или уровень кетонов в крови > 1,5 ммоль/л может указывать на ДКА, особенно если у детей есть также боль в животе, рвота, сонливость или учащенное дыхание.
Низкие уровни кетонов мочи или уровни кетонов крови от 0,6 до 1,5 ммоль/л также требуют принятия мер.
Когда обнаруживают кетоны, детям дополнительно вводят инсулин короткого действия, обычно 10-—20% от общей суточной дозы, каждые 2 — 3 ч до тех пор, пока не исчезнут кетоны.
Кроме того, чтобы предотвратить обезвоживание, необходимо давать дополнительную жидкость.
Эта программа измерения кетонов и введения дополнительной жидкости и инсулина во время болезни и/или гипергликемии называется «лечение на больничном».
Родители должны быть проинструктированы сообщить медперсоналу или обратится в отделение неотложной помощи, если кетоны увеличиваются или не исчезают через 4 — 6 ч, или если ухудшается клиническое состояние (например, развивается дыхательная недостаточность, продолжительная рвота, изменение психического статуса).
Лечения сахарного диабета 2 типа
Как и при СД 1 типа, является важным изменение образа жизни, а именно улучшение питания и повышение физической активности.
Инсулин начинают давать детям, которые обращаются с более тяжелым СД (НЬA1c > 9% или ДКА); может быть использован гларгин, детемир или комбинированные инсулины.
Если нет ацидоза, как правило, в то же время начинают метформин. Потребность в инсулине может быстро снижаться в течение первых недель лечения, когда увеличивается секреция эндогенного инсулина; инсулин часто приостанавливают через несколько недель после восстановления приемлемого метаболического контроля.
Метформин является активатором инсулина и единственным пероральным антигипергликемическим препаратом, одобренным для пациентов < 18 лет.
Другие пероральные препараты, используемые у взрослых, могут быть полезны некоторым подросткам, но они являются более дорогостоящими, и данные об их использовании в этой возрастной группе ограничены.
Метформин следует начинать с низкой дозы и принимать с пищей, чтобы предотвратить тошноту и боль в животе. Обычно начальная доза составляет 500 мг один раз в день в течение 1 недели, она увеличивается еженедельно на 500 мг в течение 3 — 6 недель пока, не достигнет максимальной дозы 1000 мг перорально 2 раза в день.
Целью лечения является снижение гликолизированого гемоглобина (HbA1c ) < 6,5%.
Если этого нельзя достигнуть с помощью метформина, необходимо начинать прием инсулина. К сожалению, около половины подростков с СД 2 типа не отвечают на монотерапию метформином и, в конечном итоге, нуждаются в инсулине.
Лечение моногенных форм диабета
Терапия моногенных форм диабета индивидуализированна и зависит от подтипа.
Подтип глюкокиназы обычно не требует лечения, потому что дети не подвержены риску долгосрочных осложнений.
Большинство пациентов с подтипами HNF-4-α и HNF-1-α отвечают на лечение сульфонилмочевиной, но некоторые в конечном итоге нуждаются в инсулине.
Другие пероральные сахароснижающие препараты, такие как метформин, как правило, не эффективны.
Мониторинг уровней глюкозы и HbA1c
Регулярное обследование включает:
-
Несколько ежедневных проверок глюкозы капилярной крови
-
Измерение НЬA1c каждые 3 месяца
При СД 1 типа, уровень глюкозы крови следует измерять, используя образцы капилярной крови перед всеми приемами пищи и до перекуса перед сном.
Также следует проверять уровни ночью (около 2 — 3 ночи), при подозрении на ночную гипогликемию (например, из-за гипогликемии или энергичных упражнений в течение дня, или когда повышают дозу инсулина).
Поскольку физические упражнения могут снижать уровни глюкозы в течение 24 ч, уровни следует проверять чаще в те дни, когда дети делают упражнения или более активны. Чтобы предотвратить гипогликемию, дети могут увеличить потребление углеводов или понизить дозу инсулина, перед повышенной активностью.
«Лечение на больничном» следует проводить при гипергликемии или болезни.
Родители должны ежедневно подробно записывать все факторы, которые могут повлиять на контроль гликемии, в том числе уровни глюкозы крови, время введения и дозы инсулина, потребление углеводов и уровень физической активности; а также любые другие релевантные факторы (например, болезнь, поздние перекусы, пропуски доз инсулина).
Системы непрерывного мониторинга уровня глюкозы (CGM) используют подкожный датчик для измерения уровня глюкозы в межклеточной жидкости каждые 1 — 5 минут. Системы CGM откалиброваны с учетом уровней глюкозы в капилярной крови и передают результаты беспроводным путем на устройства мониторинга и индикации, которые могут быть встроены в инсулиновую помпу или работать отдельно.
Определяя случаи устойчивой гипергликемии и эпизоды повышенного риска гипогликемии, системы CGM помогают пациентам с СД 1 типа более безопасно контролировать гликемию. В
се устройства позволяют устанавливать целевые уровни; сигналы предупредят пользователя, если уровень глюкозы выше или ниже целевого, и некоторые CGM, встроенные в помпу, могут приостановить введение базальной дозы до 2 ч, когда уровень глюкозы падает ниже установленного порога.
Несмотря на то, что CGM устройства могут использоваться при любом режиме, их, как правило используют пациенты с инсулиновой помпой.
При СД 2 типа, уровень глюкозы в крови следует измерять регулярно, но, как правило, реже, чем при СД 1 типа.
Частота самоконтроля уровня глюкозы крови (SMBG) должна быть индивидуализирован с учетом уровней глюкозы пациента натощак и после приема пищи, степени контроля гликемии, которая считается достижимой, и имеющихся ресурсов.
Частота мониторинга должна увеличиваться, если не удается добиться контроля гликемии, во время болезни, или когда ощущаются симптомы гипогликемии или гипергликемии.
Как только достигаются цели лечения, домашнее тестирование, сводится к нескольким измереням глюкозы крови натощак и после еды в неделю.
Уров ни HbA 1c следует измерять каждые 3 месяца при СД 1 типа и СД 2 типа, если используется инсулин или метаболический контроль не является оптимальным.
В противном случае, при СД 2 типа, измерения можно проводить 2 раза в год, хотя оптимальная частота — каждые 3 месяца.
Скрининг на осложнения СД
Пациентов регулярно обследуют на наличие осложнений в зависимости от типа сахарного диабета.
Если осложнения обнаружены, последующее тестирование проводится чаще.
Осложнения, обнаруженные при осмотре или скрининге, сначала лечат с помощью изменения образа жизни: увеличение физической нагрузки, диетические изменения (в частности, ограничение потребления насыщенных жиров), и отказ от курения (если применимо).
Дети с микроальбуминурией (соотношение альбумин/креатинин от 30 до 300 мг/г) при повторном обследовании, или с постоянной тенденцией к повышеннию АД (от > 90-го до 95-го процентиля, по возрасту или > 130/80 мм рт. ст. для подростков), которые не отвечают на изменение образа жизни, как правило, нуждаются в гипотензивной терапии, наиболее часто, с использованием ингибиторов АПФ.
Для детей с дислипидемией, если холестерин липопротеинов низкой плотности остается > 160 мг/дл (или > 130 мг/дл плюс один или более сердечно-сосудистых факторов риска), несмотря на изменение образа жизни, следует рассматривать применение статинов у детей > 10 лет, хотя их безопасность в долгосрочной перспективе не доказана.
Andrew Calabria, Assistant Professor of Pediatrics Attending Physician, Division of Endocrinology & Diabetes, Perelman School of Medicine at The University of Pennsylvania The Children’s Hospital of Philadelphia